ISI VE SICAKLIK
ISI
v Sıcaklıkları farklı iki maddenin arasında
gerçekleşen enerji alış verişine ısı denir.
v Isı Kalorimetre ile ölçülür.
v Birimi joule (j) veya kalori (cal)’dir.
v Isı bir enerji çeşididir.
SICAKLIK
v Maddeyi oluşturan taneciklerin ortalama
kinetik enerjisine sıcaklık denir.
v Sıcaklık Termometre ile ölçülür.
v Birimi ° C ( selsiyus derece
)’dir.
v Sıcaklı bir enerji çeşidi değildir.
Termometrenin Özellikleri
v Termometrenin içerisinde cıva ve alkol
kullanılır. Alkolün görülmesi için kırmızı ile renklendirilir.
v Alkolden yapılan termometreler çok yüksek
sıcaklıkları ölçemezler. Çünkü kaynama noktası (78 ° C) alkolün
düşüktür.
v Termometrenin içindeki sıvının donma
noktasının düşük, kaynama noktasının ise yüksek olması gerekir.
v Sıvını yükselişi sıvının genleşmesi ile
ilgilidir.
Isı
Alış-Verişi
v Sıcaklıkları farklı iki madde arasında ısı
alış-verişi gerçekleşir.
v Isı alış-verişi sıcaklıklar eşit oluncaya
kadar devam eder.
v Sıcak madde ısı verirken soğuk madde ısı
verir.
v Sıcak madde ısı verirken sıcaklığı azalır.
v Soğuk madde ısı alırken sıcaklığı artar.
v Sıcaklıklar eşit olduğu anda ısı
alış-verişi durur.
v Sıcaklıkları eşit iki madde arasında ısı
alış-verişi gerçekleşmez.
Kütle ve Sıcaklık İlişkisi
v Sıcaklık değişimi kütle miktarına
bağlıdır.
v Kütlesi fazla olan maddenin sıcaklığı az
artarken kütlesi az olanın ise sıcaklığı fazla artar. (Kütle ile sıcaklık
artışı ters orantılıdır.
Isıtıcı ve Sıcaklık İlişkisi
v Sıcaklık değişimi ısıtıcı miktarına
( verilen ısıya ) bağlıdır.
v Kütlesi eşit olan iki maddeye farklı
sayıdaki ısıtıcılar etki ederse ısıtıcı sayısı fazla olan sıvı da daha fazla
sıcaklık artışı gözlenir. (Isıtıcı sayısı ile sıcaklık artışı doğru
orantılıdır.)
MADDENİN HALLERİ
Maddeni
katı, sıvı ve gaz olmak üzere 3 hali vardır.
1.
KATI HALİ
v Maddenin en düzenli halidir.
v Tanecikler sıkı temas halindedir.
v Tanecikler arası çekim kuvveti çok fazladır.
v Tanecikler sadece titreşim hareketi yaparlar.
v Belirli bir hacmi ve şekli vardır.
v Katılar sıkıştırılamazlar.
2.
SIVI HALİ
v Katılara göre biraz daha düzensizdirler.
v Tanecikler temas halindedir.
v Tanecikler arası çekim kuvveti katılardan azdır.
v Tanecikler öteleme, dönme ve titreşim hareketi
yaparlar.
v Belli bir şekli yoktur. Belli bir hacmi vardır.
v Konulduğu kabın şeklini alırlar.
v Sıvılar sıkıştırılmazlar.
3.
GAZ HALİ
v Maddenin en düzensiz halidir.
v Tanecikler arası mesafe çok fazladır.
v Tanecikler arası çekim kuvveti çok azdır.
v Tanecikler öteleme, dönme ve titreşim hareketi
yaparlar.
v Belli bir şekli ve hacmi yoktur.
v Konulduğu kabı doldururlar.
v Gazlar sıkıştırılabilirler.
HAL DEĞİŞİM
Maddeler ısı alarak veya ısı vererek
taneciklerinin yapısının değişmesine hal değişimi denir.
Erime
= Katı haldeki bir maddenin
ısı alarak sıvı hale geçmesidir.
Buharlaşma
= Sıvı haldeki bir maddenin
ısı alarak gaz haline geçmesidir.
Süblimleşme
= Katı haldeki bir maddenin
ısı alarak direk olarak gaz hale geçmesidir.
Yoğuşma = Gaz
haldeki bir maddenin ısı vererek sıvı hale geçmesidir.
Donma = Sıvı
haldeki bir maddenin ısı vererek katı hale geçmesidir.
Kırağılaşma
= Gaz haldeki bir maddenin
ısı vererek direk katı hale geçmesidir.
Erime – Buharlaşma ve Süblimleşme olayı
gerçekleşirken;
v Madde ısı alır.
v Tanecikler arası mesafe artar.
v Tanecikler arası çekim kuvveti azalır.
v Tanecikler hızlanır.
Yoğuşma
– Donma ve Kırağılaşma olayı gerçekleşirken;
v Madde ısı verir.
v Tanecikler arası mesafe azalır.
v Tanecikler arası çekim kuvveti artar.
v Tanecikler yavaşlar.
Erime ve Donma Isısı
Erime sıcaklığındaki 1 gram katı maddenin, yine aynı
sıcaklıkta 1 gram sıvı hale geçmesine erime ısısı denir. Erime
ısısı Le ile gösterilir. Birimi j / g ‘dır.
Donma sıcaklığındaki 1 gram sıvı maddenin, yine aynı
sıcaklıkta 1 gram katı hale geçmesine donma ısısı denir. .
Erime ısısı Ld ile gösterilir. Birimi j / g ‘dır.
Bir maddenin erime ısısı donma ısısına
eşittir. ( Le = Ld )
Farklı
maddelerin erime ısıları farklıdır.
Bir maddenin erimesi veya donması için
gereken enerji miktarı hesaplanırken;
Q
= m . L
( Q = Maddenin erimesi veya donması için gereken enerji
miktarı )
( m = maddenin kütlesi )
v Kışın kar yağdığında yollara tuz atılması ve soğuk
havalarda arabalara antifriz konulması sıvıların donma noktasını aşağı düşürmek
ve sıvının donmasını engellemektir.
Buharlaşma ve Yoğuşma Isısı
Buharlaşma sıcaklığındaki 1 gram sıvı maddenin, yine aynı sıcaklıkta 1 gram gaz
hale geçmesine buharlaşma ısısı denir. Buharlaşma ısısı Lb ile
gösterilir. Birimi j / g ‘dır.
Yoğuşma sıcaklığındaki 1 gram gaz maddenin, yine aynı sıcaklıkta 1 gram sıvı
hale geçmesine yoğuşma ısısı denir. Yoğuşma ısısı Ly ile
gösterilir. Birimi j / g ‘dır.
Bir
maddenin buharlaşma ısısı yoğuşma ısısına eşittir. ( Lb
= Ly )
Farklı maddelerin buharlaşma ısıları farklıdır.
Bir maddenin
buharlaşma veya yoğuşma için gereken enerji miktarı hesaplanırken;
Q
= m . L
( Q =
Maddenin buharlaşma veya yoğuşma için gereken enerji miktarı )
( m = maddenin kütlesi )
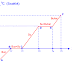
ISINMA VE SOĞUMA GRAFİKLERİ
ISINMA GRAFİĞİ
Suyun ısınma grafiği altta
verilmiştir. Donma noktası 0 ° C, Kaynama noktası ise 100 ° C ‘dir. Suyun
ısınma grafiğinin bölgelere göre incelenmesi aşağıdaki gibidir.
v A noktasında maddemiz katı (Buz) haldedir.
v A – B arasında su katı haldedir. Sıcaklık
artmaktadır.
v Buz B noktasında erimeye başlamıştır.
v B – C arasında maddemiz hal
değiştirmektedir. ( Erime )
v B – C arasında sıcaklık sabittir.( Saf
maddeler hal değiştirirken sıcaklık değişmez.)
v B – C arasında su ve buz karışım halindedir.
( Heterojen Karışım )
v C noktasında maddemiz tamamen erimiştir.
v C – D arasında sıcaklık artmaktadır.
v C – D arasında maddemiz sıvı haldedir.
v D noktasında su hal değiştirmeye
başlamıştır. ( Buharlaşma )
v D – E arasında madde hal değiştiriyor ve
sıcaklık sabittir.
v D – E arasında su ve su buharı karışım
halindedir.
v E noktasında su tamamen buharlaşmıştır.
v E – F arasında su buharı bulunmaktadır.
Sıcaklık artmaktadır.
SOĞUMA GRAFİĞİ
Suyun soğuma grafiği altta verilmiştir.
Donma noktası 0 ° C, Kaynama noktası ise 100 ° C ‘dir. Suyun soğuma grafiğinin
bölgelere göre incelenmesi aşağıdaki gibidir.
v F noktasında maddemiz gaz (su buharı)
haldedir.
v F - E arasında su gaz haldedir. Sıcaklık
azalmaktadır.
v Su buharı E noktasında yoğuşmaya
başlamıştır.
v E –D arasında maddemiz hal
değiştirmektedir. ( Yoğuşma )
v E –D arasında sıcaklık sabittir.
v E –D arasında su ve buhar karışım
halindedir.
v D noktasında maddemiz tamamen yoğuşmuştur.
v C – D arasında sıcaklık azalmaktadır.
v C – D arasında maddemiz sıvı haldedir.
v C noktasında su hal değiştirmeye
başlamıştır. ( Donma )
v C – B arasında madde hal değiştiriyor ve
sıcaklık sabittir.
v C – B arasında su ve buz karışım
halindedir. ( Heterojen Karışım )
v B noktasında su tamamen donmuştur.
v B - A arasında buz bulunmaktadır. Sıcaklık
azalmaktadır.
NOT: Suyun donma noktasını düşürmek
için suya tuz atılır. Kışın yerlere tuz atılmasının nedeni de suyun donma
noktasını düşürmektir.